Biến cơ chế bảo vệ của vi trùng chống lại virus thành công cụ mạnh mẽ nhất trong di truyền học, chiếc kéo phân tử CRISPR/Cas9 đã mang về cho hai nhà khoa học nữ Emmanuelle Charpentier và Jennifer Doudna giải Nobel Hóa học năm 2020. Bà Pernilla Wittung-Stafshede, thành viên của Ủy ban Nobel Hóa học, nói đây là “một giải thưởng tuyệt vời”, “Khả năng cắt ADN ở nơi bạn muốn đã tạo ra một cuộc cách mạng trong ngành khoa học sự sống”.
Chiếc kéo di truyền mới được phát hiện cách đây 8 năm, nhưng đã mang lại lợi ích rất nhiều cho nhân loại. Bà nói tại buổi công bố giải Nobel Hóa học ngày 7-10-2020 ở Stockholm: “Chỉ có trí tưởng tượng mới đặt ra giới hạn cho những gì công cụ hóa học này có thể được sử dụng trong tương lai. Có lẽ ước mơ chữa khỏi bệnh di truyền sẽ thành hiện thực”. Nhưng ngay sau đó, bà đổi giọng, nói rằng đạo đức và luật pháp cũng rất quan trọng để xác định những gì có thể và nên được thực hiện với công cụ này vì một số chỉnh sửa gien người gây nhiều tranh cãi.
Một phát minh đáng giá hàng tỉ đô la
Công cụ là một chiếc kéo phân tử được lập trình gọi là CRISPR/Cas9, trên thực tế đã được sử dụng bởi vi khuẩn từ hàng triệu đến hàng tỷ năm để chống lại những cuộc tấn công của siêu vi khuẩn. Trở lại với những năm 1980, các nhà nghiên cứu đã lưu ý một kiểu gien di truyền khá lạ trong nhiều loài vi khuẩn. Đó là một đoạn ADN bình thường đọc tới hay đọc lui đều giống nhau, tiếp nối bởi một đoạn nhìn qua như thể đám rác, rồi sau đó là một bảng màu palindromic khác, và cứ thế liên tục. Người ta không biết các phân đoạn này dùng để làm gì, nhưng rất ấn tượng và các nhà khoa học châu Âu lúc đó gọi chúng là “Clustered Regularly Interspaced Short Palindromic Repeats”, viết tắt là CRISPR.
Sau này người ta mới biết các chuỗi bí ẩn đó là một hệ miễn dịch. Khi một loại vi khuẩn tiếp xúc với một loại virus, nó sẽ cắt một mẫu ADN của kẻ xâm lược (rác) và lưu trữ nó một cách an toàn giữa hai dải phân cách. Bằng cách đó, nếu loài virus này quay trở lại tấn công, con vi khuẩn chỉ cần tham khảo kho lưu trữ của nó và đưa ra phản ứng miễn dịch thích hợp. Việc khám phá quy trình hoạt động của bãi chôn rác CRISPR rất quan trọng. Năm 2011, nhà vi trùng học Emmanuelle Charpentier đã xác định rằng sơ đồ CRISPR có 3 thành phần chính: một loại enzyme hoạt động giống như một cái kéo cắt các chuỗi xoắn kép ADN; một RNA hướng dẫn cho biết chiếc kéo phải cắt vào đâu, và một bộ phận khóa kéo vào vị trí.

Năm sau, Charpentier hợp tác với nhà hóa sinh Jennifer Doudna, và cả hai chứng minh cho thế giới thấy hệ thống này đáng giá hàng tỉ đô la, bằng việc sử dụng nó để chỉnh sửa gen di truyền. CRISPR trở thành một công cụ vô tiền khoáng hậu và làm phá sản các công cụ di truyền trước đó. Để chỉnh sửa gen bằng CRISPR, tất cả những gì bạn phải làm là cung cấp cho nó một RNA hướng dẫn địa chỉ vị trí cụ thể trên bộ gen. Cái kéo sau đó sẽ cắt đoạn gen đã chọn ra khỏi bộ gen và chèn vào đó một vật thay thế. Các bộ gen có cơ chế sửa chữa tự nhiên nên sẽ tự động khâu vá toàn bộ lại với nhau.
Sức mạnh của một phát kiến khoa học
Doudna của Đại học California ở Berkeley, và Charpentier, hiện là giám đốc của Viện Sinh học Nhiễm trùng Max Planck ở Berlin, đã gặp nhau vào năm 2011 tại một hội nghị ở Puerto Rico. “Chúng tôi đi dạo quanh Old San Juan và nói về CRISPR/Cas9,” Doudna nhớ lại trong cuộc họp báo ảo vào ngày 7 tháng 10. Các nhà khoa học quyết định hợp tác để nghiên cứu hệ thống phòng thủ của vi khuẩn và cuối cùng biến nó thành một trình biên tập gen. CRISPR/Cas9 gồm hai phần được tạo thành từ một RNA dẫn đường và một enzyme, Cas9, có nhiệm vụ cắt chuỗi ADN. Phát minh của họ là tạo ra một RNA dẫn đường duy nhất giúp cho Cas9 cắt đúng vào vị trí muốn cắt trên dãy di truyền ADN.
“Bài báo mà họ xuất bản cùng nhau đã được trích dẫn hơn 9.500 lần – khoảng 8 giờ một lần kể từ khi xuất bản vào năm 2012”, David Liu của Viện Y khoa Howard Hughes cho biết. Liu cùng các nhà sinh học khác đã thay đổi hệ thống CRISPR ban đầu để dùng nó vào các mục đích khác nhau. Luis Echegoyen, nhà hóa học tại Đại học Texas ở El Paso và là chủ tịch của Hiệp hội Hóa học Hoa Kỳ cho biết “chiến thắng là rất được mong đợi. Tôi nghĩ mọi người đã nói về CRISPR từ lâu rồi”. Vị giáo sư này cho rằng thời gian mang thai từ khi phát hiện đến khi đoạt giải thường rất dài, nhưng với CRISPR đã là quá hạn.
Stanley Qi, nhà kỹ thuật sinh học và nhà công nghệ sinh học tại Đại học Stanford, từng làm việc tại phòng thí nghiệm của Douna cho biết lời hứa của CRISPR ngay lập tức rõ ràng “Trong tám năm này, đã có rất nhiều đột phá và tiến bộ, nó vượt xa sự mong đợi của tôi”. Doudna và Charpentier “đã tiếp tục xem xét các loại enzyme CRISPR”, Qi nói. Công việc liên tục của họ đã đóng góp cái nhìn sâu sắc mới về sự tiến hóa và các cơ chế đằng sau cách hệ thống vi khuẩn hoạt động. Ông cho biết, công trình của Doudna nhằm xác định cấu trúc và chức năng của enzym Cas9 đã đặt nền tảng cho việc cải thiện độ chính xác và hiệu quả của việc chỉnh sửa gien.
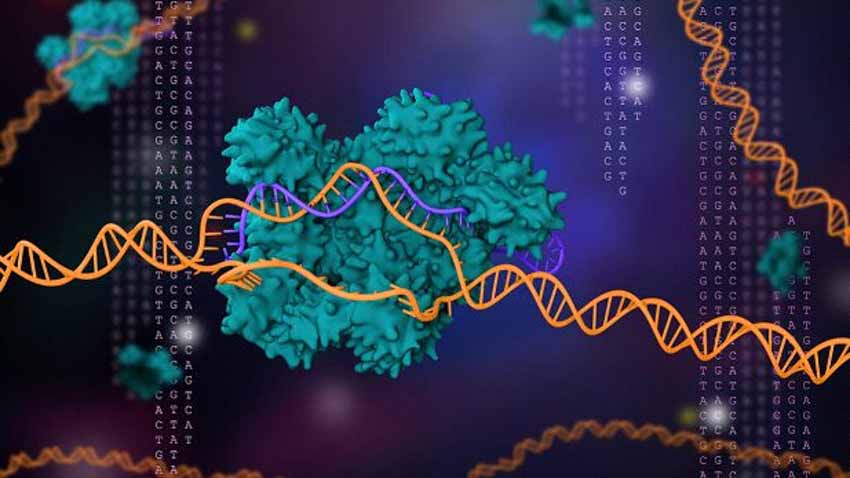
Đặt khoa học vào nền tảng đạo đức và luật pháp
Nhiều nhà nghiên cứu hiện đã đưa những chiếc kéo di truyền này sang bước tiếp theo, sử dụng CRISPR/Cas9 để cắt và chỉnh sửa gen trong tế bào người. Các nhà khoa học khen ngợi CRISPR rẻ, linh hoạt và dễ sử dụng. Họ cũng đã dùng nó để chỉnh sửa gien ở nhiều loại động vật, bao gồm chó, chuột, bướm, bò, lợn, ốc và muỗi. Thực vật và nấm cũng đã được xử lý CRISPR. Và trình chỉnh sửa gien đã được sử dụng để lập trình lại các tế bào miễn dịch của con người để chống lại ung thư và biến các tế bào ung thư chống lại nhau. Gây tranh cãi nhất là khi một nhà khoa học ở Trung Quốc đã chỉnh sửa gien trong phôi thai người, sinh ra hai bé gái vào năm 2018.
Với sức mạnh to lớn của CRISPR gây ra tranh cãi lớn, Doudna đã cảnh báo vấn đề trong cuốn sách ‘A Crack in Creation’ với đồng tác giả Samuel Sternberg. Trong khi trình chỉnh sửa gen có thể được sử dụng để tiêu diệt các loài xâm lấn và ngăn muỗi mang bệnh, nó cũng có thể khiến toàn bộ loài tuyệt chủng hoặc tạo ra các thảm họa sinh thái. Các nhà khoa học đã xóa sổ các quần thể muỗi nhỏ trong phòng thí nghiệm bằng cách sử dụng máy sao chép phân tử dựa trên CRISPR được gọi là ổ gien. Việc chỉnh sửa gien trng phôi thai người đã tạo nên một làn sóng phản đối dữ dội. Nhưng người ta sợ rằng cánh cửa đã mở cho “trẻ sơ sinh có thiết kế riêng”, sự bất bình đẳng trong chăm sóc sức khỏe và các hành vi lạm dụng khác.
“Sức mạnh to lớn của công nghệ này có nghĩa là chúng ta cần sử dụng nó một cách cẩn thận”, Claes Gustafsson, chủ tịch Ủy ban Nobel Hóa học, cho biết tại cuộc họp báo. “Nhưng rõ ràng không kém rằng đây là một công nghệ sẽ mang đến cho nhân loại những cơ hội tuyệt vời”. Hy vọng hơn nữa, các thử nghiệm lâm sàng kiểm tra khả năng điều trị ung thư, bệnh hồng cầu hình liềm, beta-thalassemia và mù di truyền của CRISPR/Cas9 đã bắt đầu vào năm 2019. Nếu thành công, CRISPR/Cas9 có thể cung cấp các liệu pháp hoặc thậm chí chữa khỏi các tình trạng di truyền không thể điều trị trước đây. CRISPR cũng đóng một vai trò trong đại dịch coronavirus, với các xét nghiệm chẩn đoán dựa trên CRISPR cho COVID-19 và các liệu pháp đang được phát triển.